| Tabela Periódica: |
| |
A tabela periódica foi uma forma que os cientistas descobriram de organizar os elementos químicos, de tal maneira que as semelhanças e as diferenças entre eles ficassem mais evidentes. O primeiro a propor uma tabela periódica dos elementos que atendia às necessidades dos químicos foi Dimitri Ivanovitch Mendeleev, em 1869.
Na tabela periódica os elementos são organizados em linhas
horizontais, chamadas períodos ou séries, e linhas verticais ou colunas,
chamadas grupos ou famílias. |
Tabela Periódica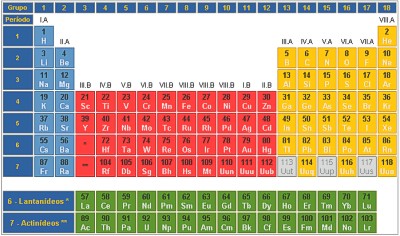
| Organização da Tabela
(Blocos): |
| |
|
Elementos Representativos,
com elétron mais energético no subnível "s" |
| |
| |
|
Elementos Representativos,
com elétron mais energético no subnível "p" |
| |
| |
|
Elementos de Transição
Externa, com elétron mais energético no subnível "d" |
| |
| |
|
Elementos de Transição Interna,
com elétron mais energético no subnível "f" (Séries
dos Lantanídeos e dos Actinídeos) |
| |
| Grupos ou Famílias: |
| |
A tabela periódica atual é
constituída de 18 grupos. Cada um deles agrupa elementos com
propriedades químicas semelhantes, pois apresentam a mesma
configuração eletrônica na camada de valência |
| Períodos ou Séries: |
| |
O número do período corresponde
à quantidade de níveis (ou camadas) eletrônicos
apresentados pelos elementos químicos. Na tabela atual existem
sete períodos ou séries |
| Número Atômico: |
| |
Indica a quantidade de prótons existentes
no núcleo de um átomo, que é igual à quantidade
de elétrons (para um átomo eletricamente neutro) |
| Peso Atômico: |
| |
É a massa atômica relativa ao isótopo 12 do Carbono (12C) |
| Eletronegatividade: |
| |
É uma medida relativa da força de atração
exercida pelos átomos sobre os elétrons de uma ligação |
© 2000-2001 Alfredo J G A Borba
|



